作者:喷喷最健康
链接:https://www.zhihu.com/question/431906581/answer/1608064983
来源:知乎
著作权归作者所有。商业转载请联系作者获得授权,非商业转载请注明出处。
批估计是要批,长期有效性/安全性有待观察,存在潜在风险。这个风险主要来自于两个部分:
一,原理上的缺陷。所有灭火苗都存在的Th2倾向的免疫激活,这个也不例外,科兴发布的文章中代表Th1响应比例的IFNgamma激活T细胞计数远远低于辉瑞,并且有相当数量的受试者该计数为0。这个问题曾在RSV灭火苗上导致过长期保护率变成负数,并导致实验组接种者一年后患病,重症不治。对于有免疫逃逸可能性的病毒(rsv/疱疹/麻疹等),Th2倾向造成的问题尤其显著,而新冠目前是否有自己的免疫逃逸/免疫抑制机制尚不明确,有一些研究文献表明新冠可能有此类机制。
二,生产上的不确定性。包括vero作为一种癌细胞系本身的稳定性问题,产能放大时的代际控制问题(国家标准对vero一个批次内可以繁殖的最大代数有要求,越大的批次这一点越不好控制),病毒本身在生产中的突变风险。此外还有病毒蛋白缺乏特异性分离手段从而目前主要靠IEX/SEC等相对低特异性的分离手段进行纯化,以及加速佐剂制剂后最终病毒颗粒组分复杂引起的宿主细胞蛋白掺杂问题。这些非抗原蛋白可能引起其他不必要的过敏反应和自身免疫反应,带来与增加免疫力和保护战力无关的风险,如GBS等自身免疫疾病。如果商用苗的生产管控和高福组七月份发在Science上的流程类似,并且同样最后只靠跑胶确定蛋白组分,基本不可能排除宿主细胞蛋白掺杂的影响,事实上文章中就已经可以观察到相当明显的未解释条带。由于这个病毒小鼠攻毒实验和人体上效果差距较大,传统上靠小鼠攻毒把最后一关的做法能否成立也值得怀疑。
这是个提纲,不删的话,慢慢扩写。
关于第一点,首先讲讲免疫系统在遇到疫苗和病原体时候的基本工作原理。活的单链RNA病毒本质上是一个蛋白质坨坨,里面包着一堆RNA和蛋白质的复合体,当它和表面有受体(比如这次的ACE2)的体细胞结合的时候,就可以被胞吞作用吃进去,然后外壳解体,里面的RNA暴露,被翻译出包括RNA-RNA复制酶(rdrp)在内的一堆病毒蛋白质,开始复制,组装,最后通过外泌体或者宿主细胞的死亡裂解释放到外面。大部分的疫苗也是尺度接近(纳米尺度)的可莉,这种东西对于人体来说都属于明显的异物,树状细胞就是免疫系统中专门负责识别这类异物的细胞,它会将病毒或者疫苗捡起来吃掉,然后将细胞内的外源蛋白质在溶酶体内切碎,通过一种叫MHC的膜蛋白把碎片挂在自己的表面。如果是病毒感染,这个蛋白就是病毒自己复制生产出来的,如果是核酸疫苗,这个蛋白就是疫苗核酸翻译出来的,如果是灭活/重组蛋白,这个东西就是疫苗本身。挂在树状细胞上面的蛋白碎片-MHC复合体会被T细胞识别,使得T细胞“认识”这么个碎片,然后开启适应性免疫,变为表达CD4的辅助T细胞(CD4+ Th)和表达CD8的杀手T细胞。
CD4+辅助T细胞在进一步接触同一个碎片-MHC复合体的时候,就可以开始分裂增殖,同时分化成为效应T细胞或记忆T细胞,并分泌细胞因子。细胞因子是一大类信号分子的总称,可以形成正反馈循环,促进T细胞的增殖分化,激活巨噬细胞等其他免疫细胞,从而产生更多的信号分子。根据这个分泌的细胞因子不同,辅助T细胞的响应可以被分为很多大类。在这里需要讲的重点就是Th1和Th2两种反应。
Th1主要介导的是细胞免疫反应。Th1激活的CD4+辅助T细胞会大量分泌干扰素gamma,干扰素gamma可以促进更多Th1 CD4+辅助T细胞分化成熟,并帮助巨噬细胞和特异性的杀手T细胞等等的活化。已经感染病毒的体细胞会在表面呈递病毒的蛋白碎片,这些碎片可以被之前被训练过的杀手T细胞识别,进而实现对已经被感染了病毒的细胞进行毒杀,进而防止它们进一步生产病毒。同时一些Th1反应下的辅助T细胞会形成记忆T细胞,方便下次见到同一个抗原迅速开打。Th2主要介导体液免疫反应,Th2激活的辅助T细胞会分泌一系列白细胞介素(IL一家),激活肥大细胞和B细胞等等,量产抗体。B细胞一开始生产IgM,后面会有几率变成记忆B细胞并逐渐转产IgG。
对于不同的病原体,这两种激活的意义是不同的。有些病原体主要在细胞外造成破坏,比如细菌增殖,毒素分泌之类的,这种情况下Th2就是“正确的”“好的”免疫反应。但是对于病毒来说,这里存在几个问题:第一,疫苗的蛋白和病毒的蛋白不完全一致,可能导致最后抗体特异性不足,第二,抗体结合了病毒以后,不一定能确保病毒进入细胞以后能被溶酶体直接摧毁,有时候抗体带着病毒进去了之后还没进溶酶体就掉下来了,这样病毒仍然可以释放RNA完成感染。一般来说,特异性越好,量越大的抗体,抗病毒效果越好(废话),但是疫苗带来的Th2不一定总是能让B细胞分泌这样的抗体,同时会分泌抗体的B细胞不一定总是能变成记忆B细胞,而只有记忆B细胞下次遇到病毒的时候才能继续分泌正确的抗体。
而对于流感新冠之类的RNA-RNA复制的病毒,Th1带来的细胞免疫就至关重要。因为抗体对已经进了细胞开始复制的病毒几乎没有任何办法。一旦记忆B细胞数量不足/随时间下降,或者感染的病毒和疫苗抗原有些不同导致抗体结合效率不足,抗体就非但不能阻止感染扩散,还有可能帮助病毒进入细胞加重感染。这种情况下,细胞免疫反应留存的记忆T细胞可以迅速活化,促进特异性CD8杀手T细胞的分化,从而及时在体细胞生产更多病毒前将其杀死。所以在对流感新冠之类的东西的保护作用中,Th1响应强不强就至关重要。
那么为什么灭活/重组蛋白疫苗会有Th1不行这么个问题呢?之前说过Th1上最重要的细胞因子是一种干扰素,而最能刺激干扰素产生的东西就是双链RNA。人类在进化中已经摒弃了RNA到RNA的复制过程,因此一旦树状细胞内检测到RNA-RNA双链,它会认为这个东西一定是外来的病毒,于是开始分泌包括干扰素gamma在内的干扰素,引起强Th1反应。病毒的rdrp复制RNA必然会导致这样的RNA双链,mRNA疫苗则可以通过序列设计和生产工艺优化,人工的加入双链部分,从而促进干扰素gamma的分泌,但是灭活疫苗和重组蛋白疫苗就完全没有这么个东西,也就无法引起Th1响应。事实上已有的绝大多数灭活疫苗都有巨大的Th2 bias,这也被认为是流感疫苗有效性长期低下的原因之一。
那么为什么那么多灭活疫苗,有的保护效力是正的,有的却会是零甚至是复数呢?这更多是病毒本身的机制和特性决定的。
接着写写麻疹和RSV的故事,这一段就不再是教科书内容了,会涉及到paper。我写的时候看的一些paper的链接我会发在里面,非专业的看不看都行,专业的看到写错了的部分欢迎斧正。
当年六七十年代的时候,算是疫苗推广的一个高峰,也是美国反疫苗运动的一个高峰。那个时候很多病毒的灭活都被研发了出来,基本原理和今天的很多灭活也没有什么本质的区别,养病毒—福尔马林或者什么别的灭活—铝佐剂制剂。但是之后大家就发现个问题:原理差不多的疫苗,都是单链RNA病毒,有的灭活很好(比如狂犬病),有的能用(比如流感),有的没卵用(比如麻疹),有的灭活完全不能用(比如RSV)。现在非常常见的麻疹(麻腮风疫苗)是减毒活疫苗。而在六七十年代,曾经短暂上市过一段时间的麻疹灭活疫苗,间隔一个月给两针,过了一年却只有25%的小孩还有中和抗体。如果一年后再打一针,过了9个月又只剩69%的人还有抗体了。缺少有效中和抗体造成的保护力低下导致最后43%打了疫苗接触了病毒的小孩得上了麻疹,而与此对应的,天然麻疹得一次几乎终身免疫,减毒活疫苗两针97%有效率可以持续很多年。为什么会有这样的区别,在那个生命科学还远没有今天发达的时代属于未解之谜。
如果说麻疹灭活疫苗不好用还只是个烦人的小问题,RSV灭活疫苗则堪称彻头彻尾的悲剧。RSV是一种很常见的呼吸道单链RNA病毒,一些小孩得过也就自己好了,因此很多人实际上对这个病毒有一定免疫力。1966年RSV灭活疫苗进入临床阶段,一开始一切都还算顺利,此前没有被RSV感染过的小孩的抗体计数增长了4倍,然而仅仅不到一年,大家就发现,此前没有RSV免疫力并接种过灭活RSV疫苗的小孩在感染RSV时,症状非常显著的加重:通常小孩感染RSV后住院率约为5%,接种疫苗的小孩住院率高达80%。
https://cvi.asm.org/content/23/3/189cvi.asm.org
在最低龄组(6-11个月)中,对照组总和RSV住院率仅为0.86%,疫苗组高达13.7%。
https://academic.oup.com/aje/article/89/4/435/198864academic.oup.com
随着两名实验组儿童死于严重RSV相关症状(enhanced RSV disease,ERD),RSV灭活疫苗被迅速叫停,随后科学家对这一问题的原因展开了深入的研究。这里研究太多了,机制也不止一个,但是都和疫苗激起的强烈Th2倾向免疫反应有关。一个比较重要的方面是,Th2免疫反应造成B细胞不仅仅分泌了抗病毒用的IgG和IgM,记忆B细胞再次遇到抗原时还会分泌大量IgE。这些没有中和能力的IgE并不能起到防止病毒感染的作用,反而在结合病毒以后藉由其Fc区域(屁股)与在体细胞膜上的Fc受体结合引起胞吞,帮助了病毒进入体细胞,极大加速了病毒感染的节奏,使得原本常见、相对温和的RSV变得凶暴致命。
这次新冠期间,很多人可能听说了IgM IgG检测,以及先有IgM后有IgG这样的简单规律,但是完全没有听说过IgE这种抗体。IgE这种抗体正常情形下含量比较小,目前认为它主要的保护作用是用于对抗一些寄生虫。一些人更熟悉的遇到它的场景则是一些过敏,比如花生过敏中,就会有B细胞参与分泌大量IgE。从进化的角度来说,Th2应对的是各类东西的“碎片”“尸体”,它更多是用于对抗细胞外的感染源的,比如寄生虫和细菌,以及它们分泌的毒素。它所准备的一整套免疫应对机制:比如IgE这种抗寄生虫抗体分泌,抗寄生虫专精的嗜酸性粒细胞的活化,肥大细胞释放的组胺等等,都是非常适用于对抗寄生虫的,在进化的长河中为人类的生存能力没少添砖加瓦。但是因为灭活疫苗是一坨蛋白,对于免疫系统来说,它更像一个寄生虫身上的碎渣,或者某个细菌分泌的毒蛋白,而不是一个拉进细胞后能感染细胞复制自己的病毒。
那么这里就涉及到之前说的一个问题了:为什么都是单链RNA病毒,都是灭活病毒+铝佐剂,有的行有的不行呢?最彳亍的如狂犬病,灭活的甚至都不是原版病毒而是个减毒毒株,都能实现100%保护。很行的比如乙肝,能有个90-95%,流感没那么行,在毒株赌对的时候也能有60%以上的保护。而麻疹和RSV,一个保护率低保护时间短,一个保护率干脆是负数。即使是现在,人类对这个问题也没有一个确定的答案,以至于曾经有人(好像是Merck疫苗研发一个导演,记不清了)说过,“我们根本不知道这些疫苗是怎么工作的,我们只是打进去试试看试出来了一些”。对于狂犬病,即使灭活疫苗,也能够激起相当的均衡Th1/Th2反应,没有特别显著的Th2 bias:
Cellular immune response following pre-exposure and postexposure rabies vaccination by intradermal and intramuscular routes
为啥会这样?不知道。
同时由于狂犬病具有的嗜神经细胞的特点,致病时感染的细胞数量相对于对几乎所有细胞都有感染力的流感之类的东西要少得多,因此清楚细胞内病毒要求的杀手T细胞数量也要低,同时病毒繁殖进展也会慢。这使得狂犬病有相当长的潜伏期,被感染后及时注射疫苗甚至可以实现治愈效果,这在病毒中时非常罕见的。
乙肝的特点是血液传播,血液中本来抗体含量就比呼吸道之类的地方高。同时乙肝感染后可以把自己变成DNA,相当长时间不引起细胞免疫机制的注意,原本就不需要多强的细胞免疫来阻碍第一次感染。因此灭活/重组蛋白也很早就做成,并且非常成功。
而流感这个病毒,特点就是复制快,不挑食。新冠这种你在细胞表面还需要有个ACE2蛋白作为受体,流感则不需要特定的受体,它的结合目标是唾液酸。大家都知道细胞表面有很多膜蛋白,膜蛋白有很多都会有糖基化,而唾液酸是一种非常常见的糖单元,通常挂在糖链的末尾。顺便一提,不同哺乳动物的唾液酸本身的结构以及唾液酸挂的位置都会有所区别,这也就是为什么有些流感只在动物之间传,有些可以动物传人,有些可以人传人,本质原因是它们识别的唾液酸相关结构不同。这个识别唾液酸结构的组件叫血凝素,也就是流感H几N几里的那个H。这种简单粗暴见啥感染啥的机制使得流感病情进展非常快,传播广泛,而传播广泛带来的结构就是流感家族成员众多,而且大家的免疫系统都多少见过流感一家人一点。免疫系统比我们想象的要聪明,当它见过活的流感病毒,又见到了死的另一种流感病毒,它可以实现Th1和2之间的转化:
https://academic.oup.com/jid/article/180/3/579/808028
这个机制很可能导致流感疫苗最后引起的Th1比疫苗本身引起的要高不少,类似于打了一次灭活疫苗+打了一次减毒活疫苗。
而麻疹相对来说种类就没那么多了。虽然曾经也是广泛传播,但是得了一次几乎终身免疫的特点,使得麻疹灭活疫苗对于那些有对减毒病毒株免疫力的人没有意义,对于没有减毒病毒株预存免疫力的人效果差很多。除此以外,麻疹还有个很鸡贼的机制,它能让免疫系统倾向Th2,抑制Th1反应:
Measles virus-induced suppression of immune responseswww.ncbi.nlm.nih.gov
具体原理上,麻疹病毒可以通过下调人体IL-12的表达,影响干扰素gamma等细胞因子的分泌:
Mechanism of Suppression of Cell-Mediated Immunity by Measles Virusscience.sciencemag.org
可以说,在预防麻疹这件事上,本来缺的就是Th1,疫苗提供的Th1又不够,自然就效果差。
而RSV的免疫操纵情形由于病毒本身的结构复杂性,病毒生命周期步骤更多,导致比麻疹要复杂非常多,研究了这么多年仍然没有一个明确的结论。RSV在感染初期可以通过影响树状细胞活化T细胞,来为自己争取时间:
https://www.frontiersin.org/articles/10.3389/fimmu.2019.00810/fullwww.frontiersin.org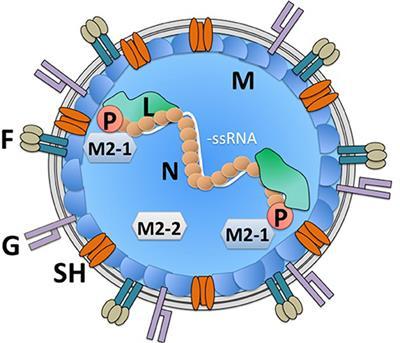
在这段细胞免疫整体缺失的时间窗口内,如果存在可以帮助RSV加速感染的IgE抗体,就很容易让RSV感染格外规模扩大。这之后细胞免疫上来了,一看卧槽这么多细胞都被感染了,赶紧大开杀戒,于是就造成了典型的呼吸道病毒重症情形:免疫过度激活,细胞因子风暴,器官被干到衰竭等等。除此以外,RSV的一个主要抗原蛋白F蛋白存在prefusion和postfusion两个加工状态,prefusion蛋白结合细胞表面受体以后会变成postfusion状态,因此对于蛋白在体外合成的灭活疫苗,免疫系统见到的F蛋白绝大多数都是postfusion状态的,而不是具有感染力的prefusion状态的。因此大部分RSV灭活疫苗产生的RSV抗体大部分都会有结合效率不足导致的中和力低下。直到今天,仍然没有任何获批上市的RSV疫苗。在特殊的RSV ERD老鼠模型上,已经有证据显示mRNA的RSV疫苗具有保护能力,并且不会引起ERD,这个mRNA疫苗已经上了临床,目前实验还在慢慢做。
那么说了这么多别的病毒,新冠有没有麻疹和RSV这样的机制呢?作为一个才出现一年,研究必须要在P3实验室才能进行的病毒,当然不可能已经被研究的很清楚。目前已知的一些机制包括NK细胞的exhaustion,和RSV类似的树状细胞干扰等等。冠状病毒和流感一样,也是一种非常常见的病毒,是普通感冒的第二大原因,人对冠状病毒家族中的某一员或多或说都能有一点预存免疫。这种预存免疫能不能帮助人类把灭活新冠疫苗的Th2偏好掰回来?目前不知道。同时,新冠的主要抗原蛋白S蛋白也存在prefusion和postfusion两个形态,如果用野生病毒株灭活,同样会存在免疫系统只见过postfusion的S蛋白的问题,这会不会导致抗体特异性底下和中和能力下降?也不知道。Novavax为了解决这个问题,它们的重组蛋白疫苗引入了S-2P突变来将重组S蛋白锁定在prefusion构象。除此以外他们在序列设计中还彻底抹掉了一个可能Furin切点,这是个更复杂的问题,暂且不表。
所以,面对新冠这种单链RNA,依赖RNA到RNA复制病毒,疫苗能引起Th1/2均衡,或者倾向Th1的免疫反应是很有意义的。
灭活疫苗也并不是在这方面没有任何进步——人类发现以前灭活疫苗常用的铝佐剂有强烈的Th2倾向以后,一直在研究新的能更好的激发Th1反应的佐剂,主要机理包括和细胞内的识别RNA的蛋白结合等等。然而这一次,国药和科兴用的仍然是铝佐剂。结果可以参考BNTX和科兴生物发的一期数据中的biomarker分析部分:
COVID-19 vaccine BNT162b1 elicits human antibody and TH1 T cell responseswww.nature.com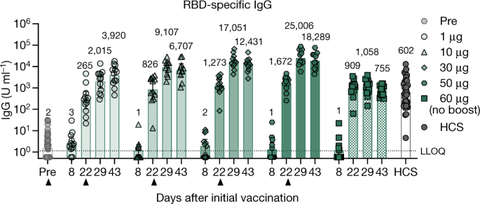
Figure 3 为总IFNgamma表达T细胞,Figure 4 为新冠RBD特异性T细胞,和
https://www.thelancet.com/cms/10.1016/S1473-3099(20)30843-4/attachment/d42552a5-d7e8-4d10-ba37-eccff01cc36d/mmc2.pdfwww.thelancet.com
Figure S7,总IFNgamma表达T细胞。前面说过,IFNgamma是Th1的重要特征,因此经常用它来观测Th1反应的强度。
最后实用化的剂量中,辉瑞(30ug)IFNgamma+的T细胞计数约为200-2000每百万个外周血单个核细胞,均值约500-600,而科兴的灭活疫苗这一计数为0-6每十万个(即0-60每百万个),有相当数量的受试者没有产生任何IFNgamma+的T细胞,均值约为2-3每十万个(20-30每百万个),整个低了一个数量级还多,说明二者Th1诱导能力完全不在一个级别。
这种强Th2倾向的免疫诱导,会不会和麻疹一样造成有效性低下,免疫力留存能力下降,或者RSV那样的感染后症状加强?还是和流感一样凑合着用无伤大雅?目前我们还不知道,只有时间,以及严谨的临床试验设计、受试者追踪才能证明。但是Th2倾向造成的风险是实实在在存在,并造成过严重后果的。
以上是第一点展开写。第二点随缘更
编辑于昨天 18:10
真诚赞赏,手留余香
链接:https://www.zhihu.com/question/431906581/answer/1608064983
来源:知乎
著作权归作者所有。商业转载请联系作者获得授权,非商业转载请注明出处。
批估计是要批,长期有效性/安全性有待观察,存在潜在风险。这个风险主要来自于两个部分:
一,原理上的缺陷。所有灭火苗都存在的Th2倾向的免疫激活,这个也不例外,科兴发布的文章中代表Th1响应比例的IFNgamma激活T细胞计数远远低于辉瑞,并且有相当数量的受试者该计数为0。这个问题曾在RSV灭火苗上导致过长期保护率变成负数,并导致实验组接种者一年后患病,重症不治。对于有免疫逃逸可能性的病毒(rsv/疱疹/麻疹等),Th2倾向造成的问题尤其显著,而新冠目前是否有自己的免疫逃逸/免疫抑制机制尚不明确,有一些研究文献表明新冠可能有此类机制。
二,生产上的不确定性。包括vero作为一种癌细胞系本身的稳定性问题,产能放大时的代际控制问题(国家标准对vero一个批次内可以繁殖的最大代数有要求,越大的批次这一点越不好控制),病毒本身在生产中的突变风险。此外还有病毒蛋白缺乏特异性分离手段从而目前主要靠IEX/SEC等相对低特异性的分离手段进行纯化,以及加速佐剂制剂后最终病毒颗粒组分复杂引起的宿主细胞蛋白掺杂问题。这些非抗原蛋白可能引起其他不必要的过敏反应和自身免疫反应,带来与增加免疫力和保护战力无关的风险,如GBS等自身免疫疾病。如果商用苗的生产管控和高福组七月份发在Science上的流程类似,并且同样最后只靠跑胶确定蛋白组分,基本不可能排除宿主细胞蛋白掺杂的影响,事实上文章中就已经可以观察到相当明显的未解释条带。由于这个病毒小鼠攻毒实验和人体上效果差距较大,传统上靠小鼠攻毒把最后一关的做法能否成立也值得怀疑。
这是个提纲,不删的话,慢慢扩写。
关于第一点,首先讲讲免疫系统在遇到疫苗和病原体时候的基本工作原理。活的单链RNA病毒本质上是一个蛋白质坨坨,里面包着一堆RNA和蛋白质的复合体,当它和表面有受体(比如这次的ACE2)的体细胞结合的时候,就可以被胞吞作用吃进去,然后外壳解体,里面的RNA暴露,被翻译出包括RNA-RNA复制酶(rdrp)在内的一堆病毒蛋白质,开始复制,组装,最后通过外泌体或者宿主细胞的死亡裂解释放到外面。大部分的疫苗也是尺度接近(纳米尺度)的可莉,这种东西对于人体来说都属于明显的异物,树状细胞就是免疫系统中专门负责识别这类异物的细胞,它会将病毒或者疫苗捡起来吃掉,然后将细胞内的外源蛋白质在溶酶体内切碎,通过一种叫MHC的膜蛋白把碎片挂在自己的表面。如果是病毒感染,这个蛋白就是病毒自己复制生产出来的,如果是核酸疫苗,这个蛋白就是疫苗核酸翻译出来的,如果是灭活/重组蛋白,这个东西就是疫苗本身。挂在树状细胞上面的蛋白碎片-MHC复合体会被T细胞识别,使得T细胞“认识”这么个碎片,然后开启适应性免疫,变为表达CD4的辅助T细胞(CD4+ Th)和表达CD8的杀手T细胞。
CD4+辅助T细胞在进一步接触同一个碎片-MHC复合体的时候,就可以开始分裂增殖,同时分化成为效应T细胞或记忆T细胞,并分泌细胞因子。细胞因子是一大类信号分子的总称,可以形成正反馈循环,促进T细胞的增殖分化,激活巨噬细胞等其他免疫细胞,从而产生更多的信号分子。根据这个分泌的细胞因子不同,辅助T细胞的响应可以被分为很多大类。在这里需要讲的重点就是Th1和Th2两种反应。
Th1主要介导的是细胞免疫反应。Th1激活的CD4+辅助T细胞会大量分泌干扰素gamma,干扰素gamma可以促进更多Th1 CD4+辅助T细胞分化成熟,并帮助巨噬细胞和特异性的杀手T细胞等等的活化。已经感染病毒的体细胞会在表面呈递病毒的蛋白碎片,这些碎片可以被之前被训练过的杀手T细胞识别,进而实现对已经被感染了病毒的细胞进行毒杀,进而防止它们进一步生产病毒。同时一些Th1反应下的辅助T细胞会形成记忆T细胞,方便下次见到同一个抗原迅速开打。Th2主要介导体液免疫反应,Th2激活的辅助T细胞会分泌一系列白细胞介素(IL一家),激活肥大细胞和B细胞等等,量产抗体。B细胞一开始生产IgM,后面会有几率变成记忆B细胞并逐渐转产IgG。
对于不同的病原体,这两种激活的意义是不同的。有些病原体主要在细胞外造成破坏,比如细菌增殖,毒素分泌之类的,这种情况下Th2就是“正确的”“好的”免疫反应。但是对于病毒来说,这里存在几个问题:第一,疫苗的蛋白和病毒的蛋白不完全一致,可能导致最后抗体特异性不足,第二,抗体结合了病毒以后,不一定能确保病毒进入细胞以后能被溶酶体直接摧毁,有时候抗体带着病毒进去了之后还没进溶酶体就掉下来了,这样病毒仍然可以释放RNA完成感染。一般来说,特异性越好,量越大的抗体,抗病毒效果越好(废话),但是疫苗带来的Th2不一定总是能让B细胞分泌这样的抗体,同时会分泌抗体的B细胞不一定总是能变成记忆B细胞,而只有记忆B细胞下次遇到病毒的时候才能继续分泌正确的抗体。
而对于流感新冠之类的RNA-RNA复制的病毒,Th1带来的细胞免疫就至关重要。因为抗体对已经进了细胞开始复制的病毒几乎没有任何办法。一旦记忆B细胞数量不足/随时间下降,或者感染的病毒和疫苗抗原有些不同导致抗体结合效率不足,抗体就非但不能阻止感染扩散,还有可能帮助病毒进入细胞加重感染。这种情况下,细胞免疫反应留存的记忆T细胞可以迅速活化,促进特异性CD8杀手T细胞的分化,从而及时在体细胞生产更多病毒前将其杀死。所以在对流感新冠之类的东西的保护作用中,Th1响应强不强就至关重要。
那么为什么灭活/重组蛋白疫苗会有Th1不行这么个问题呢?之前说过Th1上最重要的细胞因子是一种干扰素,而最能刺激干扰素产生的东西就是双链RNA。人类在进化中已经摒弃了RNA到RNA的复制过程,因此一旦树状细胞内检测到RNA-RNA双链,它会认为这个东西一定是外来的病毒,于是开始分泌包括干扰素gamma在内的干扰素,引起强Th1反应。病毒的rdrp复制RNA必然会导致这样的RNA双链,mRNA疫苗则可以通过序列设计和生产工艺优化,人工的加入双链部分,从而促进干扰素gamma的分泌,但是灭活疫苗和重组蛋白疫苗就完全没有这么个东西,也就无法引起Th1响应。事实上已有的绝大多数灭活疫苗都有巨大的Th2 bias,这也被认为是流感疫苗有效性长期低下的原因之一。
那么为什么那么多灭活疫苗,有的保护效力是正的,有的却会是零甚至是复数呢?这更多是病毒本身的机制和特性决定的。
接着写写麻疹和RSV的故事,这一段就不再是教科书内容了,会涉及到paper。我写的时候看的一些paper的链接我会发在里面,非专业的看不看都行,专业的看到写错了的部分欢迎斧正。
当年六七十年代的时候,算是疫苗推广的一个高峰,也是美国反疫苗运动的一个高峰。那个时候很多病毒的灭活都被研发了出来,基本原理和今天的很多灭活也没有什么本质的区别,养病毒—福尔马林或者什么别的灭活—铝佐剂制剂。但是之后大家就发现个问题:原理差不多的疫苗,都是单链RNA病毒,有的灭活很好(比如狂犬病),有的能用(比如流感),有的没卵用(比如麻疹),有的灭活完全不能用(比如RSV)。现在非常常见的麻疹(麻腮风疫苗)是减毒活疫苗。而在六七十年代,曾经短暂上市过一段时间的麻疹灭活疫苗,间隔一个月给两针,过了一年却只有25%的小孩还有中和抗体。如果一年后再打一针,过了9个月又只剩69%的人还有抗体了。缺少有效中和抗体造成的保护力低下导致最后43%打了疫苗接触了病毒的小孩得上了麻疹,而与此对应的,天然麻疹得一次几乎终身免疫,减毒活疫苗两针97%有效率可以持续很多年。为什么会有这样的区别,在那个生命科学还远没有今天发达的时代属于未解之谜。
如果说麻疹灭活疫苗不好用还只是个烦人的小问题,RSV灭活疫苗则堪称彻头彻尾的悲剧。RSV是一种很常见的呼吸道单链RNA病毒,一些小孩得过也就自己好了,因此很多人实际上对这个病毒有一定免疫力。1966年RSV灭活疫苗进入临床阶段,一开始一切都还算顺利,此前没有被RSV感染过的小孩的抗体计数增长了4倍,然而仅仅不到一年,大家就发现,此前没有RSV免疫力并接种过灭活RSV疫苗的小孩在感染RSV时,症状非常显著的加重:通常小孩感染RSV后住院率约为5%,接种疫苗的小孩住院率高达80%。
https://cvi.asm.org/content/23/3/189cvi.asm.org
在最低龄组(6-11个月)中,对照组总和RSV住院率仅为0.86%,疫苗组高达13.7%。
https://academic.oup.com/aje/article/89/4/435/198864academic.oup.com
随着两名实验组儿童死于严重RSV相关症状(enhanced RSV disease,ERD),RSV灭活疫苗被迅速叫停,随后科学家对这一问题的原因展开了深入的研究。这里研究太多了,机制也不止一个,但是都和疫苗激起的强烈Th2倾向免疫反应有关。一个比较重要的方面是,Th2免疫反应造成B细胞不仅仅分泌了抗病毒用的IgG和IgM,记忆B细胞再次遇到抗原时还会分泌大量IgE。这些没有中和能力的IgE并不能起到防止病毒感染的作用,反而在结合病毒以后藉由其Fc区域(屁股)与在体细胞膜上的Fc受体结合引起胞吞,帮助了病毒进入体细胞,极大加速了病毒感染的节奏,使得原本常见、相对温和的RSV变得凶暴致命。
这次新冠期间,很多人可能听说了IgM IgG检测,以及先有IgM后有IgG这样的简单规律,但是完全没有听说过IgE这种抗体。IgE这种抗体正常情形下含量比较小,目前认为它主要的保护作用是用于对抗一些寄生虫。一些人更熟悉的遇到它的场景则是一些过敏,比如花生过敏中,就会有B细胞参与分泌大量IgE。从进化的角度来说,Th2应对的是各类东西的“碎片”“尸体”,它更多是用于对抗细胞外的感染源的,比如寄生虫和细菌,以及它们分泌的毒素。它所准备的一整套免疫应对机制:比如IgE这种抗寄生虫抗体分泌,抗寄生虫专精的嗜酸性粒细胞的活化,肥大细胞释放的组胺等等,都是非常适用于对抗寄生虫的,在进化的长河中为人类的生存能力没少添砖加瓦。但是因为灭活疫苗是一坨蛋白,对于免疫系统来说,它更像一个寄生虫身上的碎渣,或者某个细菌分泌的毒蛋白,而不是一个拉进细胞后能感染细胞复制自己的病毒。
那么这里就涉及到之前说的一个问题了:为什么都是单链RNA病毒,都是灭活病毒+铝佐剂,有的行有的不行呢?最彳亍的如狂犬病,灭活的甚至都不是原版病毒而是个减毒毒株,都能实现100%保护。很行的比如乙肝,能有个90-95%,流感没那么行,在毒株赌对的时候也能有60%以上的保护。而麻疹和RSV,一个保护率低保护时间短,一个保护率干脆是负数。即使是现在,人类对这个问题也没有一个确定的答案,以至于曾经有人(好像是Merck疫苗研发一个导演,记不清了)说过,“我们根本不知道这些疫苗是怎么工作的,我们只是打进去试试看试出来了一些”。对于狂犬病,即使灭活疫苗,也能够激起相当的均衡Th1/Th2反应,没有特别显著的Th2 bias:
Cellular immune response following pre-exposure and postexposure rabies vaccination by intradermal and intramuscular routes
为啥会这样?不知道。
同时由于狂犬病具有的嗜神经细胞的特点,致病时感染的细胞数量相对于对几乎所有细胞都有感染力的流感之类的东西要少得多,因此清楚细胞内病毒要求的杀手T细胞数量也要低,同时病毒繁殖进展也会慢。这使得狂犬病有相当长的潜伏期,被感染后及时注射疫苗甚至可以实现治愈效果,这在病毒中时非常罕见的。
乙肝的特点是血液传播,血液中本来抗体含量就比呼吸道之类的地方高。同时乙肝感染后可以把自己变成DNA,相当长时间不引起细胞免疫机制的注意,原本就不需要多强的细胞免疫来阻碍第一次感染。因此灭活/重组蛋白也很早就做成,并且非常成功。
而流感这个病毒,特点就是复制快,不挑食。新冠这种你在细胞表面还需要有个ACE2蛋白作为受体,流感则不需要特定的受体,它的结合目标是唾液酸。大家都知道细胞表面有很多膜蛋白,膜蛋白有很多都会有糖基化,而唾液酸是一种非常常见的糖单元,通常挂在糖链的末尾。顺便一提,不同哺乳动物的唾液酸本身的结构以及唾液酸挂的位置都会有所区别,这也就是为什么有些流感只在动物之间传,有些可以动物传人,有些可以人传人,本质原因是它们识别的唾液酸相关结构不同。这个识别唾液酸结构的组件叫血凝素,也就是流感H几N几里的那个H。这种简单粗暴见啥感染啥的机制使得流感病情进展非常快,传播广泛,而传播广泛带来的结构就是流感家族成员众多,而且大家的免疫系统都多少见过流感一家人一点。免疫系统比我们想象的要聪明,当它见过活的流感病毒,又见到了死的另一种流感病毒,它可以实现Th1和2之间的转化:
https://academic.oup.com/jid/article/180/3/579/808028
这个机制很可能导致流感疫苗最后引起的Th1比疫苗本身引起的要高不少,类似于打了一次灭活疫苗+打了一次减毒活疫苗。
而麻疹相对来说种类就没那么多了。虽然曾经也是广泛传播,但是得了一次几乎终身免疫的特点,使得麻疹灭活疫苗对于那些有对减毒病毒株免疫力的人没有意义,对于没有减毒病毒株预存免疫力的人效果差很多。除此以外,麻疹还有个很鸡贼的机制,它能让免疫系统倾向Th2,抑制Th1反应:
Measles virus-induced suppression of immune responseswww.ncbi.nlm.nih.gov

具体原理上,麻疹病毒可以通过下调人体IL-12的表达,影响干扰素gamma等细胞因子的分泌:
Mechanism of Suppression of Cell-Mediated Immunity by Measles Virusscience.sciencemag.org
可以说,在预防麻疹这件事上,本来缺的就是Th1,疫苗提供的Th1又不够,自然就效果差。
而RSV的免疫操纵情形由于病毒本身的结构复杂性,病毒生命周期步骤更多,导致比麻疹要复杂非常多,研究了这么多年仍然没有一个明确的结论。RSV在感染初期可以通过影响树状细胞活化T细胞,来为自己争取时间:
https://www.frontiersin.org/articles/10.3389/fimmu.2019.00810/fullwww.frontiersin.org

在这段细胞免疫整体缺失的时间窗口内,如果存在可以帮助RSV加速感染的IgE抗体,就很容易让RSV感染格外规模扩大。这之后细胞免疫上来了,一看卧槽这么多细胞都被感染了,赶紧大开杀戒,于是就造成了典型的呼吸道病毒重症情形:免疫过度激活,细胞因子风暴,器官被干到衰竭等等。除此以外,RSV的一个主要抗原蛋白F蛋白存在prefusion和postfusion两个加工状态,prefusion蛋白结合细胞表面受体以后会变成postfusion状态,因此对于蛋白在体外合成的灭活疫苗,免疫系统见到的F蛋白绝大多数都是postfusion状态的,而不是具有感染力的prefusion状态的。因此大部分RSV灭活疫苗产生的RSV抗体大部分都会有结合效率不足导致的中和力低下。直到今天,仍然没有任何获批上市的RSV疫苗。在特殊的RSV ERD老鼠模型上,已经有证据显示mRNA的RSV疫苗具有保护能力,并且不会引起ERD,这个mRNA疫苗已经上了临床,目前实验还在慢慢做。
那么说了这么多别的病毒,新冠有没有麻疹和RSV这样的机制呢?作为一个才出现一年,研究必须要在P3实验室才能进行的病毒,当然不可能已经被研究的很清楚。目前已知的一些机制包括NK细胞的exhaustion,和RSV类似的树状细胞干扰等等。冠状病毒和流感一样,也是一种非常常见的病毒,是普通感冒的第二大原因,人对冠状病毒家族中的某一员或多或说都能有一点预存免疫。这种预存免疫能不能帮助人类把灭活新冠疫苗的Th2偏好掰回来?目前不知道。同时,新冠的主要抗原蛋白S蛋白也存在prefusion和postfusion两个形态,如果用野生病毒株灭活,同样会存在免疫系统只见过postfusion的S蛋白的问题,这会不会导致抗体特异性底下和中和能力下降?也不知道。Novavax为了解决这个问题,它们的重组蛋白疫苗引入了S-2P突变来将重组S蛋白锁定在prefusion构象。除此以外他们在序列设计中还彻底抹掉了一个可能Furin切点,这是个更复杂的问题,暂且不表。
所以,面对新冠这种单链RNA,依赖RNA到RNA复制病毒,疫苗能引起Th1/2均衡,或者倾向Th1的免疫反应是很有意义的。
灭活疫苗也并不是在这方面没有任何进步——人类发现以前灭活疫苗常用的铝佐剂有强烈的Th2倾向以后,一直在研究新的能更好的激发Th1反应的佐剂,主要机理包括和细胞内的识别RNA的蛋白结合等等。然而这一次,国药和科兴用的仍然是铝佐剂。结果可以参考BNTX和科兴生物发的一期数据中的biomarker分析部分:
COVID-19 vaccine BNT162b1 elicits human antibody and TH1 T cell responseswww.nature.com

Figure 3 为总IFNgamma表达T细胞,Figure 4 为新冠RBD特异性T细胞,和
https://www.thelancet.com/cms/10.1016/S1473-3099(20)30843-4/attachment/d42552a5-d7e8-4d10-ba37-eccff01cc36d/mmc2.pdfwww.thelancet.com
Figure S7,总IFNgamma表达T细胞。前面说过,IFNgamma是Th1的重要特征,因此经常用它来观测Th1反应的强度。
最后实用化的剂量中,辉瑞(30ug)IFNgamma+的T细胞计数约为200-2000每百万个外周血单个核细胞,均值约500-600,而科兴的灭活疫苗这一计数为0-6每十万个(即0-60每百万个),有相当数量的受试者没有产生任何IFNgamma+的T细胞,均值约为2-3每十万个(20-30每百万个),整个低了一个数量级还多,说明二者Th1诱导能力完全不在一个级别。
这种强Th2倾向的免疫诱导,会不会和麻疹一样造成有效性低下,免疫力留存能力下降,或者RSV那样的感染后症状加强?还是和流感一样凑合着用无伤大雅?目前我们还不知道,只有时间,以及严谨的临床试验设计、受试者追踪才能证明。但是Th2倾向造成的风险是实实在在存在,并造成过严重后果的。
以上是第一点展开写。第二点随缘更
编辑于昨天 18:10
真诚赞赏,手留余香
