因为你看的都不是官方文章。如今互联网上垃圾遍地。除了CDC,FDA,以及专业医学杂志,其他文章都没啥可信度。
我建议你,以后凡是非各国审批机构,专业医学杂志,就不要引用了,英文的也不行。一样垃圾遍地。
下面是FDA审批文件里对于“确诊新冠病例”的定义,核酸检测阳性是必须的。
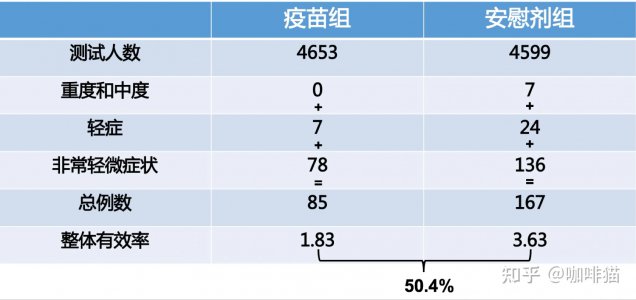
同样,科兴巴西疫苗确诊标准,核酸检测阳性也是必须的。
这些标准,全世界监管机构,都是一样的;
制定这些审批标准的,是CDC,FDA,各国医疗监管部门,不是辉瑞也不是科兴;
For the primary efficacy endpoint, the case definition for a confirmed COVID-19 case was the presence of at least one of the following symptoms and a positive SARS-CoV-2 NAAT within 4 days of the symptomatic period:
• Fever;
• New or increased cough;
• New or increased shortness of breath;
• Chills;
• New or increased muscle pain;
• New loss of taste or smell;
• Sore throat;
• Diarrhea;
• Vomiting.
For a secondary efficacy endpoint, a second definition, which may be updated as more is learned about COVID-19, included the following additional symptoms defined by CDC (listed at https://www.cdc.gov/coronavirus/2019-ncov/symptoms-testing/symptoms.html):
• Fatigue;
• Headache;
• Nasal congestion or runny nose;
• Nausea.
For another secondary endpoint, the case definition for a severe COVID-19 case was a confirmed COVID-19 case with at least one of the following:
• Clinical signs at rest indicative of severe systemic illness (RR ≥30 breaths per minute, HR ≥125 beats per minute, SpO2 ≤93% on room air at sea level, or PaO2/FiO2 <300 mm Hg);
• Respiratory failure (defined as needing high-flow oxygen, noninvasive ventilation, mechanical ventilation, or ECMO);
• Evidence of shock (SBP <90 mm Hg, DBP <60 mm Hg, or requiring vasopressors)
14
Pfizer-BioNTech COVID-19 Vaccine Emergency Use Authorization Review Memorandum
• Significant acute renal, hepatic, or neurologic dysfunction;
• Admission to an ICU; • Death.
Evaluation of safety
The primary safety objective for all phases was to de
你是看不懂别人在质疑什么吗?我有说核酸检测不是必须的吗?哪国的临床试验,确定两组的最终病例数,是只靠看症状的?当然是要核酸检测确定。这还要你教?
我就问你,辉瑞的三期临床有效率,在计算最终病例数时,有没有计入核酸检测阳性,但是无症状的感染者?我看的所有报道都是没有,而且都说辉瑞也不披露两组中到底最后有多少无症状感染者。但是Moderna的披露了,牛津也披露了,就是上面68%和28%那两个数字的来源。(我看过的一个中文报道,说辉瑞的试验只对明显出症状的进行核酸检测来确诊,对其他无症状的试验者,并没有定期的全面核酸检测,所以他们并不掌握准确的,无症状感染预防机率数字,而Moderna的试验,在每次打针前,都要进行全员核酸检测,所以他们有数字。而巴西的布坦坦,能先后给出科兴疫苗临床有效率78%和总体有效率50.4%,说明他们也是有进行定期全面核酸筛查的,而不只针对试验人群中的有症状者)
你说我举的报道都不权威,都在撒谎,请你援引出你认为权威可信的数字和计算方法,来直接反驳。而不是顾左右而言他。
谢谢!
最后编辑: 2021-01-15